7. Sınıf Saf Madde ve Karışımlar Konu Anlatımı

Atom, Bileşik, Çözünme, Damıtma, Evsel Atıklar, Element, Molekül, Homojen Karışım, Heterojen Karışım, Buharlaştırma, Yoğunluk Farkı, Geri Dönüşüm kavramlarının bolca karşımıza çıkacağı Saf Madde ve Karışımlar konusunun detayları aşağıda yazımızda.
Saf Madde ve Karışımlar
- Maddenin Tanecikli Yapısı
- Saf Maddeler
- Karışımlar
- Karışımların Ayrılması
- Evsel Atıklar ve Geri Dönüşüm
Maddenin Tanecikli Yapısı
Atomun Yapısı
Kaydıraktan kayarken ya da otomobilin kapısını açarken elektriklenme, yün kazağı çıkarırken sesler çıkması elektriklenme olayına örnektir. Bu olaylar maddenin yapısındaki atomdan daha küçük parçacıklardan kaynaklanır. Elektriklenme olayı atomdan çok daha küçük parçacıkların kanıtıdır. Çevrede görülen tüm maddeler pozitif (+) ve negatif (-) yükler içerir. Birbirine sürtünerek elektriklenen cisimler arasında alınıp verilen taneciğin adı elektrondur.
Atomun merkezinde çekirdek bulunur. Çekirdekte proton ve nötronlar vardır. Çekirdek atomdan yaklaşık on bin kat küçüktür. Atom bir stadyum kadar düşünüldüğünde çekirdek stadyumun içindeki bir bilye kadardır. Elektronlar ise çekirdeğin etrafında dolanır.
»Atomun merkezinde çekirdek bulunur.
»Çekirdekte proton ve nötronlar vardır.
»Çekirdek atomdan yaklaşık on bin kat küçüktür.
»Atom bir stadyum kadar düşünüldüğünde çekirdek stadyumun içindeki bir bilye kadardır.
»Elektronlar ise çekirdeğin etrafında dolanır.
Atomun içinde bulunan ve atomu oluşturan tanecikler proton, nötron ve elektrondur.
Proton: Atomun yapısındaki pozitif (+) yüklü taneciklerdir. Protonlar atomun çekirdeğinde bulunur ve p+ sembolü ile gösterilir. Her atomun proton sayısı farklıdır. Örneğin kalsiyum atomunun çekirdeğinde yirmi tane proton varken hidrojen atomunun çekirdeğinde bir tane proton vardır.
Nötron: Atomun çekirdeğinde bulunan yüksüz taneciklerdir. Kütlesi protonun kütlesine hemen hemen eşittir. Nötron n0 sembolü ile gösterilir.
Elektron: Çekirdeğin etrafında dolanan negatif (-) yüklü taneciklerdir. Elektronlar e ̄ sembolü ile gösterilir. Kütlesi protondan yaklaşık iki bin kat küçüktür. Elektronların kütlesi proton ve nötronların kütlesinin yanında ihmal edilecek kadar küçük olduğu için atomun kütlesini çekirdek belirler. Elektronlar çekirdeğin etrafında dairesel olarak çok hızlı bir şekilde döner.
Geçmişten Günümüze Atom Kavramı
Atom hakkında ilk görüş MÖ 400’lü yıllarda Yunanlı Filozof Democritus (Demokritus) tarafından ortaya konmuştur. Democritus maddenin taneciklerden oluştuğunu savunmuş ve bu taneciklere atom adını vermiştir. Democritus atom
hakkındaki görüşlerini deneylere göre değil varsayımlara göre söylemiştir.
Democritus’a göre:
»Madde parçalara ayrıldığında en sonunda bölünemeyen bir tanecik elde edilir ve bu tanecik atomdur.
»Bütün maddeler aynı tür atomlardan oluşur.
»Atom hakkında ilk bilimsel görüş ise İngiliz bilim insanı John Dalton (Con Daltın) tarafından ortaya atılmıştır.
Dalton’a göre:
»Maddenin en küçük yapı taşı atomdur. (Maddeler çok küçük, bölünemez, yok edilemez sert taneciklerden oluşur.)
»Atom içi dolu küre şeklindedir.
»Bütün maddeler farklı tür atomlardan oluşur.
Sonraki yıllarda İngiliz Fizikçi John Joseph Thomson (Con Cozıf Tamsın) yaptığı deneyler sonucunda atomla ilgili
yeni görüşler ortaya koymuştur.
Thomson’ a göre:
» Atom, dışı tamamen pozitif yüklü bir küre olup negatif yüklü olan elektronlar kek içerisindeki gömülü üzümler
gibi bu küre içerisine gömülmüş hâldedir.
»Atomlar daha küçük taneciklerden oluştuğu için parçalanabilir.
Rutherford’ a göre:
»(+) yüklerin merkezde bulunduğunu belirtmiş bu bölgeye çekirdek adını vermiştir.
»(-) yüklerin ise çekirdek etrafında rastgele döndüğünü ifade etmiştir.
Niels Bohr’a göre:
“Bohr Atom Modeli”ne göre elektronlar çekirdeğin çevresinde ve çekirdeğe belirli uzaklıklarda bulunan katmanlar-
da dönüyordu. Bohr Atom Modeli’nden sonra gelen kuram ise “Modern Atom Teorisi”dir. Bu model bulut modeli olarak da bilinir. Bu teoriye göre elektronlar çok hızlı hareket ettiği için bunların belirli bir yörüngesi yoktur. Sadece elektronların bulunma ihtimalinin olduğu bölgeler vardır ve bu bölgeler ‘’elektron bulutu ‘’ olarak adlandırılır.
Moleküller
Aynı ya da farklı atomlar bir araya gelerek atom kümeleri oluşturabilir. Atomların oluşturduğu bu atom kümeleri molekül olarak adlandırılır.
Aynı elementlerin atomlarından oluşan moleküller element molekülü olarak adlandırılır. Element molekülleri tek çeşit atom içerir.
Farklı atomlardan oluşan moleküllerde ise atomların büyüklüğü ve özellikleri farklıdır. Bu şekildeki moleküller ise bileşik molekülü olarak adlandırılır.
Moleküllerden oluşan element ve bileşikler vardır. Ancak bütün element ve bileşikler molekül yapılı değildir.
Saf Maddeler
Aynı cins atom veya moleküllerden oluşan maddelere saf madde denir. Elementler ve bileşikler saf maddelerdir.
Elementler
»Tek cins atomdan oluşan saf maddelerdir.
»Farklı elementlerin atomları birbirinden farklıdır. Elementler atomlardan ya da aynı atomların birleşmesiyle oluşmuş moleküllerden meydana gelir.
»Elementler sembollerle gösterilir.
»Fiziksel ve kimyasal yollarla başka maddelere ayrıştırılamaz.
»Hidrojen, demir ve altın elementlere örnektir.
Bileşikler
»En az iki farklı atomun birleşmesiyle oluşan saf maddelerdir.
»Bileşiği oluşturan elementler kendi özelliklerini kaybeder.
»Bileşiği oluşturan element atomları belirli oranlarda birleşir.
»Formüllerle gösterilir.
»Bileşiklerin bazıları moleküllerden oluşur.
»Su, tuz, şeker, sodyum hidroksit, hidrojen klorür, kalsiyum oksit bileşiklere örnektir.
Hidrojen ve oksijen atomları birleşerek su moleküllerini oluşturur. Su gibi moleküllerden oluşan bileşiklere moleküler yapılı bileşikler denir.
Elementlerin Sembolleri
Elementlerin hepsi aynı anda keşfedilmemiş, zamanla keşfedilen element sayısı artmıştır. Element sayısı artınca bu elementlere isim verme ihtiyacı hissedilmiş ve elementlere bazı özelliklerine göre isimler verilmiştir. Ancak zamanla keşfedilen element sayısı arttıkça bilim insanları bilimsel iletişimi kolaylaştırmak için elementleri sembollerle
göstermişlerdir.
Farklı ülkelerde farklı alfabeler kullanılmasına rağmen elementlerin sembolleri hep aynıdır. Element sembollerinin dünyanın her yerinde aynı olması dünyadaki bilgi paylaşımını ve bilimsel iletişimi kolaylaştırır. Elementler periyodik sistem (periyodik çizelge) adı verilen bir tablo ile gösterilir.
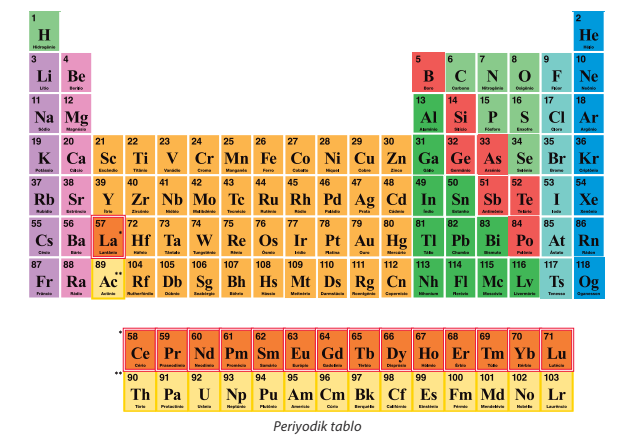
Bileşik Formülleri
Elementlerin sembollerle gösterilmesi gibi bileşiklerin formüllerle gösterilmesi de bilimsel dilde iletişim kolaylığı sağlar.
Bileşikler, bileşiği oluşturan elementlerin sembolleri ve bileşikteki birleşme oranlarını ifade eden rakamlar ile yani bileşik formülleri ile ifade edilir.
Örneğin ; su, amonyak, karbondioksit, sodyum klorür bileşik formüllerine örnek olarak verilebilir.
Karışımlar
Maddeler saf maddeler ve karışımlar olmak üzere iki gruba ayrılır.
»Birden fazla maddenin kimyasal özellikleri değişmeyecek şekilde istenilen oranda bir araya getirilmesi ile oluşan madde topluluğuna karışım denir.
»Karışımlar birden fazla element ya da bileşiğin kimyasal özellikleri değişmeden fiziksel yöntemlerle bir araya gelmesi sonucu oluşur.
»Karışımı oluşturan maddeler kendi özelliklerini kaybetmez.
»Karışımların sembol ya da formülleri yoktur.
»Karışımı oluşturan maddeler arasında belirli bir oran yoktur.
»Hava, salata, toprak farklı maddelerin bir araya gelmesi sonucu oluşan karışımlardır.
Karışımlar görünümlerine göre homojen ve heterojen karışımlar olmak üzere ikiye ayrılır.
Her yerinde aynı özelliği gösteren karışımlara homojen karışım denir. Bu karışımlara dışarıdan bakıldığında tek bir madde gibi görünür. Homojen karışımlar çözelti olarak da adlandırılır. Deniz suyu, şekerli su, tuzlu su, parfüm, homojen karışımlara örnektir.
Maddenin başka bir çözücü içinde gözle görülemeyecek kadar küçük taneciklere (atom, molekül gibi) ayrılmasına çözünme denir. Maddenin bir çözücü içinde çözünmesi ile oluşan homojen karışımlar çözeltilerdir. Çözeltiler, çözücü ve çözünenden oluşur. Çözeltilerde genellikle miktarı fazla olan madde çözücüdür. Ancak su ile hazırlanan çözeltilerde su her zaman çözücü kabul edilir. Çözeltide genellikle miktarı az olan madde çözünendir.
Her yerinde aynı özelliği göstermeyen karışımlara ise heterojen karışımlar denir. Süt, çorba, su-zeytinyağı, toprak gibi karışımlar heterojen karışımlardır.
Karışımların Ayrılması
Karışımlar fiziksel yöntemlerle oluşur ve basit fiziksel yöntemlerle kendini oluşturan maddelere ayrılabilir. Karışımlar ayrılırken karışımı oluşturan maddelerin türüne, fiziksel hâline ve karışımın çeşidine göre farklı yöntemler kullanılır.
Karışımları ayırma yöntemlerinden bazıları şunlardır:
Buharlaştırma: Katı-sıvı çözeltilerinin ayrılmasında kullanılan yöntemdir. Bu yöntemde çözelti ısıtılır, çözücü madde buharlaştırılarak karışımdan ayrılır. Kapta sadece çözünen madde (katı madde) kalır. Yaptığınız etkinlikte tuzlu su çözeltisini ısıtarak suyu buharlaştırıp kabın dibinde tuz elde edersiniz.
Yoğunluk Farkı: Yoğunluk maddeler için ayırt edici bir özelliktir. Yoğunlukları farklı maddelerden oluşan karışımlar yoğunluk farkından yararlanılarak ayrılabilir. Bu yöntemle talaş-kum ve zeytinyağı-su gibi karışımlar birbirinden ayrılabilir.
Damıtma: Kaynama noktası farklı ve birbiri içinde çözünen sıvı-sıvı çözeltilerinin ayrılmasında bu yöntemden yararlanılır. Karışımın içerisindeki maddelerin kaynama noktalarının farklı olmasından yararlanılarak birbirinden ayrılmasına damıtma yöntemi denir.
Evsel Atıklar ve Geri Dönüşüm
Geri dönüşüm yeniden değerlendirilme imkânı olan atıkların çeşitli işlemlerden geçirilerek ham maddeye dönüştürülmesi ve tekrar üretim sürecine dâhil edilmesidir. Yeniden kullanım ise atıkların toplama ve temizleme dışında hiçbir işleme tabi tutulmadan aynı şekli ile ekonomik ömrü dolana kadar defalarca kullanılmasıdır.
Günlük hayattaki aktivitelerimiz sonucu ev 0rtamında oluşan her türlü maddesel atığımıza Evsel Atık denir. Bunların bir kısmı tekrar kullanılarak geri dönüştürülebilirken bir kısmı ise tekrar geri dönüştürülemez.
Günlük faaliyetler sonucunda ev, iş yeri ve fabrikalarda endüstrinin her alanından her gün binlerce ton atık açığa çıkmaktadır. Oluşan atık maddeler günlük hayatta çöp diye ifade edilir.
Atıkların kontrolsüz biçimde bırakıldığı alanlar insan sağlığını tehdit etmektedir. Bu atıklar hastalıkların hızla yayılmasına, toprak kirlenmesine, yüzeysel suların ve yer altı sularının kirlenmesine, çevreye rahatsız edici koku yayılmasına, haşere ve böcek sorunlarının oluşmasına neden olur. Ayrıca bu alanlarda oluşan metan gazı ise patlama, heyelan ve hava kirliliği gibi problemlerin ortaya çıkmasına neden olmaktadır. Atık yönetimi konusunda ülke olarak daha iyi bir yönetim modeli oluşturabilmek için evlerden başlayarak daha bilinçli ve sorumlu davranmak gerekmektedir.
Günlük faaliyetler sonucunda ev ortamında üretilen, tehlikeli ve zararlı özellik taşımayan, yaşadığımız ortamdan uzaklaştırılması gereken her türlü katı malzeme evsel katı atıktır. Yiyecek atıkları, ev eşyası atıkları, ambalaj malzemeleri, yakacak atıkları (kül) bunlardan bazılarıdır.
Sıvı atıkların büyük bölümünü atık sular oluşturmaktadır. Bu sular; evsel, endüstriyel, zirai ve diğer kullanımlar neticesinde kirlenmiş sular ile şehir bölgelerinden gelen kanalizasyon sularıdır. Evlerde kullanılan sıvıların hemen hemen hepsi kullanım sonrası ya doğrudan ya da su ile karışarak evsel sıvı atık hâline gelir.
Geri Dönüşümün Önemi
»Doğal kaynakların korunmasını sağlar.
»Enerji tasarrufu sağlar.
»Atık miktarını azaltarak çöp işlemlerinde kolaylık sağlar.
»Sağladığı kaynak ve enerji tasarrufu sayesinde ülkenin gelişmesine ve ekonomisine katkıda bulunur.
7. Sınıf Fen Bilimleri Konuları için tıklayınız






